
Wer kennt es nicht: Nach intensivem Sport oder ungewohnten Belastungen schmerzen, Muskeln und Gelenke, Arme und Beine fühlen sich schwer an, und jede Bewegung fällt

Wer kennt es nicht: Nach intensivem Sport oder ungewohnten Belastungen schmerzen, Muskeln und Gelenke, Arme und Beine fühlen sich schwer an, und jede Bewegung fällt
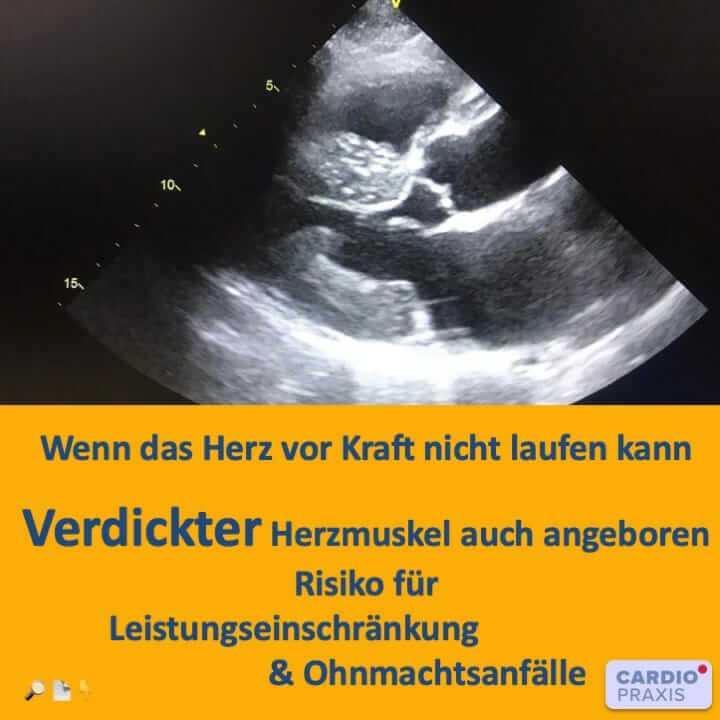
Mehr Muskelmasse! Das wünschen sich die meisten Menschen und trainieren hart dafür. Im Falle einer Herzmuskelverdickung ist dies eine gefährliche Entwicklung und muss behandelt werden.
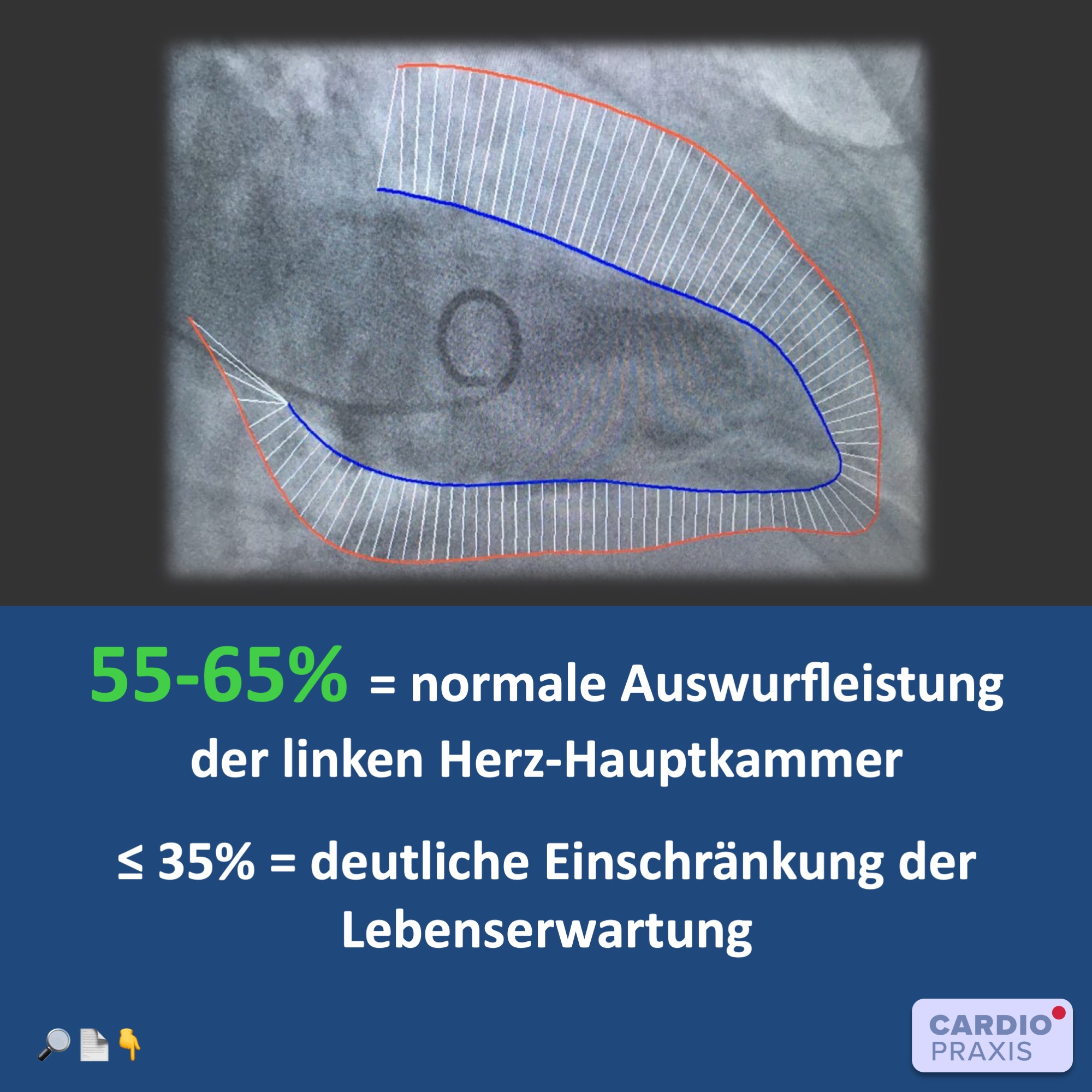
Die linksventrikuläre Ejektionsfraktion (LVEF) ist ein Schlüsselwert für die Beurteilung der Herzfunktion. Eine verminderte LVEF deutet auf eine Herzschwäche hin und ist mit einem erhöhten

Kardialer Laborparameter, der insbesondere bei der Diagnose einer Herzschwäche eine große Rolle spielt. Menschen kommen zu uns in die Sprechstunde aufgrund von erhöhten BNP-Werten. Was

Die Symptome der Herzschwäche und der Blutarmut ähneln sich. Blutarmut kommt bei Menschen mit einer Herzschwäche häufiger vor. Hier erfahren Sie, worauf Sie im Therapieverlauf

Der plötzliche Herztod bei Leistungssportlern wird in den Medien mit großer Aufmerksamkeit verfolgt und verunsichert stets aufs Neue: kann Sport gefährlich sein? Regelmäßiger Sport hält

Fühlen Sie sich schnell müde und schlapp? Ist Ihre Haut blasser als sonst? Ein Eisenmangel könnte dahinterstecken. Bei Patienten mit einer Herzschwäche führt ein Eisenmangel

Leiden Sie unter zunehmender Erschöpfung und Müdigkeit? Beim Treppensteigen bleibt Ihnen oft die Luft weg? Im Alltag fallen Ihnen gewohnte Tätigkeiten zunehmend schwerer? Dazu kommen

Die chronische Herzschwäche ist der häufigste Grund für eine Krankenhauseinweisung. Die Prognose ist ernst, das Sterberisiko höher als bei vielen Krebserkrankungen. Ein ursprünglich gegen Diabetes

Belastungstests gehören zu den wichtigsten diagnostischen kardiologischen Verfahren. In der Regel sind sie sehr sicher, Komplikationen treten extrem selten auf. Bei welchen akuten Erkrankungen kein

Der 6-Minuten-Gehtest – hilfreich bei der Bewertung von Erkrankungen des Herz-Kreislaufsystems und der Lunge Erkrankungen des Herz-Kreislaufsystems und der Lunge beeinträchtigen die körperliche Leistungsfähigkeit. Um
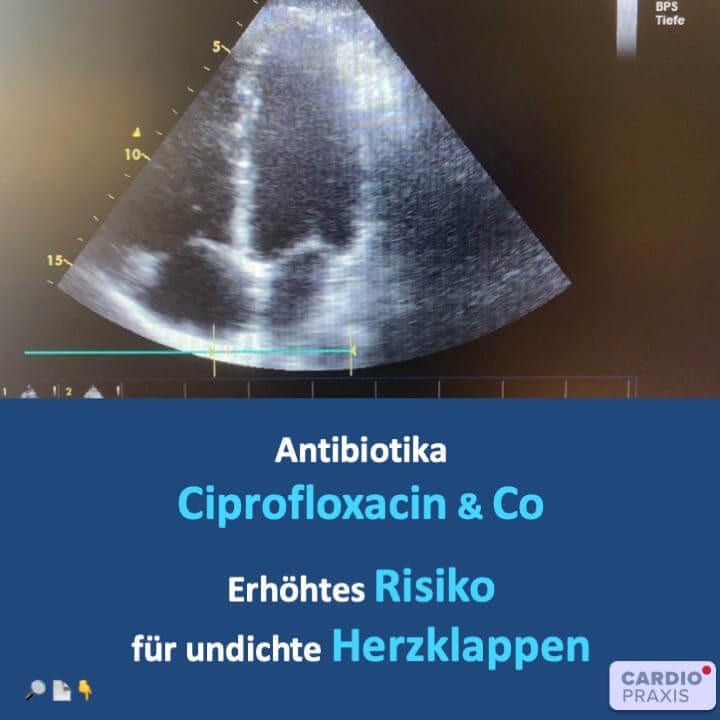
Herzklappen sind wichtig für ein leistungsfähiges Herz-Kreislaufsystem. Antibiotika vom Typ der Gyrasehemmer können bei Risikopatienten zu einer kritischen Herzklappenschädigung beitragen. Antibiotika Ciprofloxacin, Levofloxacin & Co.

Nach einem Herzinfarkt, darf nicht vor dem nächsten Herzinfarkt sein. Komplikationen des Herzinfarktes langfristig zu verhindern, darum geht es in der medikamentösen Therapie. Was hier

In der Kardiologie empfehlen wir unseren Patienten sowohl Herzschrittmacher als auch Defibrillatoren. Aber was ist eigentlich der Unterschied zwischen den Geräten und wann empfehlen wir

Was hat ein Gelenkersatz mit dem Herzen zu tun? Wussten Sie, dass es bei jedem 5. Patienten nach Eingriffen an Knie oder Hüfte zu einem

Viel Ruhe, kein Sport und keine körperliche Belastung. Das empfehlen Kardiologen, wenn Sie gerade eine Herzmuskelentzündung auskurieren müssen. Aber wann kann ich wieder sicher mit

Erkältung überstanden aber immer noch schlapp? Und besonders bei Belastung kommt Ihr Körper jetzt viel schneller an seine Grenzen? Symptome wie Herzrasen oder Luftnot nach

Erst Impotenz und dann Herzinfarkt? Erektionsprobleme können mit einer Herzerkrankung zusammenhängen klingt zunächst seltsam, ist aber nicht unüblich. Studien belegen: Erektionsprobleme können ein Symptom für

ATTR-Amyloidose und AL-Amyloidose machen 95% der Herzbeteiligung aus Die beiden häufigsten kardialen Amyloidosen sind die ATTR-Amyloidose und die AL-Amyloidose. Die Ursachen beider Amyloidose-Formen sind komplett
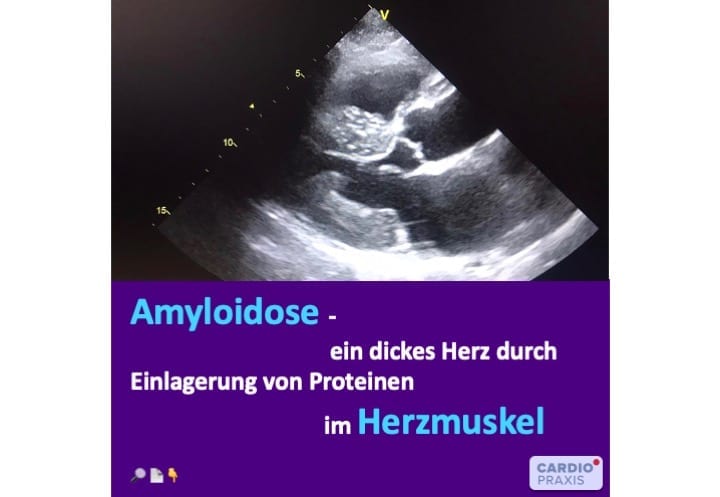
Amyloidosen: überschüssige Eiweißbildung mit Ablagerung in Organen Amyloidosen sind ein Oberbegriff für verschiedene Eiweißspeicher-Erkrankungen, die sich in Ursachen, Prognosen und Therapien unterscheiden. Hierbei produzieren Zellen
Erhalten Sie unseren Kardiologie-Newsletter einmal im Monat mit allen wichtigen Updates rund um kardiologische Themen. Bleiben Sie stets informiert. Für Ihr Herz und Ihre Gesundheit!
Liebe Patientinnen und Patienten,
am kommenden Montag, den 14. Juli 2025 schließen unsere beiden Praxen in Düsseldorf und Meerbusch bereits um 13.00 Uhr.
Ab Dienstagmorgen sind wir wieder wie gewohnt für Sie erreichbar.
Wir bitten um Ihr Verständnis.
Ihr Team der Cardiopraxis
ab Dienstag, 30. Juli 2024 werden wir unsere Terminbuchungssoftware von Samedi auf Doctolib umstellen. Zusätzlich freuen wir uns, Ihnen die Einführung unserer neuen Online-Rezeption anzukündigen. Mit diesen Veränderungen können wir unseren Service für Sie weiter verbessern.
Um Ihnen den Übergang so reibungslos wie möglich zu gestalten, haben wir intensive Vorbereitungen getroffen. Alle bereits vereinbarten Termine werden automatisch in Doctolib übertragen! Sie müssen sich also keine Sorgen machen – kein geplanter Termin geht verloren, ganz gleich ob Sie diesen online via Samedi oder bei uns direkt gebucht haben.
Dank unserer neuen und innovativen Online-Rezeption, die Sie auf unserer Website unten rechts finden, erreichen Sie uns auf direktem Wege auch außerhalb der Sprechzeiten und umgehen so die Wartezeit am Telefon. Nebst Terminvereinbarungen können Sie auf diesem Wege unter anderem auch unkompliziert Rezepte und Befunde anfordern.
Falls Sie Fragen oder Bedenken bezüglich der Umstellung haben, stehen wir Ihnen selbstverständlich zur Verfügung. Unser Praxisteam ist darauf vorbereitet, Ihnen zu helfen. Weitere Informationen zu Doctolib erhalten Sie hier in unserer Cardiothek.

Sie müssen den Inhalt von reCAPTCHA laden, um das Formular abzuschicken. Bitte beachten Sie, dass dabei Daten mit Drittanbietern ausgetauscht werden.
Mehr InformationenSie müssen den Inhalt von reCAPTCHA laden, um das Formular abzuschicken. Bitte beachten Sie, dass dabei Daten mit Drittanbietern ausgetauscht werden.
Mehr Informationen